แบบจำลองอะตอมของดอลตัน
จากการที่ไม่มีผู้ใดเห็นลักษณะอะตอมด้วยตาเปล่า John
Dalton นักวิทยาศาสตร์ชาวอังกฤษ
ได้เสนอแนวคิดเกี่ยวกับอะตอมที่เรียกว่าทฤษฎีอะตอม ในปี ค.ศ. 1803(พ.ศ.2346) มีใจความสำคัญว่า
1. สสารทุกชนิดประกอบด้วยอนุภาคที่เล็กที่สุด
ซึ่งไม่สามารถแบ่งแยกต่อไปได้อีก เรียกว่าatom
2. อะตอมของธาตุชนิดเดียวกัน
ย่อมมีสมบัติเหมือนกันทุกประการ(เช่นมีมวลเท่ากัน)
และมีสมบัติแตกต่างจากอะตอมของธาตุอื่น
3. ไม่สามารถทำให้อะตอมสูญหายหรือเกิดใหม่ได้
(กฎทรงมวล)
4. สารประกอบเกิดจากการรวมตัวทางเคมีระหว่างอะตอมของธาตุตั้งแต่สองชนิดขึ้นไป
และจำนวนอะตอมของธาตุที่รวมตัวกันจะเป็นอัตราส่วนตัวเลขลงตัวน้อยๆ
(กฎสัดส่วนคงที่)
Dalton เสนอมโนภาพของแบบจำลองอะตอมว่า
อะตอมมีลักษณะทรงกลมตัน มีขนาดเล็กมาก และไม่สามารถแบ่งแยกได้อีก
จากแนวคิดของดอลตันที่ว่า อะตอมเป็นหน่วยที่เล็กที่สุดซึ่งแบ่งแยกไม่ได้
ทำให้ได้แบบจำลองอะตอมของดอลตันเป็น “ทรงกลมที่มีขนาดเล็กที่สุด
ซึ่งแบ่งแยกไม่ได้”
แบบจำลองอะตอมของดอลตันใช้อธิบายเกี่ยวกับกฏทรงมวลสารสัมพันธ์ได้
จึงเป็นที่ยอมรับกันในสมัยนั้น
และทำให้นักวิทยาศาสตร์เริ่มหันมาสนใจศึกษาเกี่ยวกับอะตอมมากขึ้น ต่อมาเมื่อการศึกษาได้พัฒนามากขึ้น
พบข้อมูลเกี่ยวกับอะตอมมากขึ้น ข้อมูลใหม่ ๆ
เหล่านี้บางประการก็ไม่สอดคล้องกับแนวความคิดของดอลตัน เช่น
พบว่าอะตอมไม่ใช่หน่วยที่เล็กที่สุด อะตอมยังสมารถมีอนุภาคย่อย ๆ ลงไปได้อีกก
อะตอมของธาตุชนิดเดียวกันก็อาจไม่จำเป็นต้องมีสมบัติต่าง ๆ เหมือนกันทุกประการ
เช่น มีมวลต่างกันได้ (คือไอโซโทป ซึ่งจะได้กล่าวในรายละเอียดต่อไป )
นอกจากนี้ข้อมูลบางเรื่องก็ไม่สามารถอธิบายได้โดยแนวความคิดของดอลตัน เช่น
ปรากฏการณ์ที่เกิดขึ้นในหลอดรังสีแคโทด นักวิทยาศาสตร์คนต่อ ๆ
มาจึงได้พยายามเสนอแบบจำลองอะตอมชนิดใหม่
เมื่อนักวิทยาศาสตร์ได้ทำการทดลองค้นคว้าได้ข้อมูลเกี่ยวกับอะตอมมากขึ้น
พบว่าแบบจำลองของ dalton ไม่สามารถอธิบายได้ เช่น
1. ทำไมอะตอมของธาตุต่างกันจึงมีมวลต่างกัน
2. อะตอมของธาตุชนิดเดียวกันอาจมีสมบัติต่างกันได้
(เช่น ไฮโดรเจนมี 3 ไอโซโทป1H,2H และ3H
เป็นธาตุชนิดเดียวกัน แต่มีมวลต่างกัน)
3. ทำไมธาตุจึงมีความว่องไวในการเกิดปฏิกิริยาต่างกัน
4. ทำไมธาตุหนึ่งๆทำปฏิกิริยาได้เฉพาะบางธาตุ
5. อะตอมทำให้เกิดขึ้นใหม่หรือเปลี่ยนไปเป็นอะตอมของธาตุอื่นได้
หรือสามารถสังเคราะห์อะตอมของธาตุใหม่ได้โดยอาศัยปฏิกิริยานิวเคลียร์
ด้วยสาเหตุดังกล่าวจึงทำให้มีผู้ศึกษาค้นคว้าแบบจำลองอะตอมใหม่เพื่ออธิบายสิ่งที่เกิดขึ้น
แบบจำลองอะตอมของทอมสัน(1)
การทดลองของทอมสันเกี่ยวกับหลอดรังสีแคโทด
เซอร์โจเซฟ จอห์น ทอมสัน (Sir Loseph John Thomson) ได้ทำการทดลองเกี่ยวกับการนำไฟฟ้าของก๊าซในหลอดรังสีแคโทดและ
นอกจากนี้ยังมีนักวิทยาศาสตร์อื่น ๆ ที่สนใจเกี่ยวกับเรื่องนี้ เช่น ยูจีน
โกลด์สไตน์ (Eugene Goldstein) และวิลเฮล์ม วีน (Wilhelm
Wein) ซึ่งได้ทำการทดลองเกี่ยวหลอดรังสีแคโทด
โดยทอมสัน ได้ ดัดแปลงลักษณะของหลอดรังสีแคโทดจากเดิมเล็กน้อย
เช่นมีการเติมฉากเรืองแสงไว้ในหลอดรังสีด้วย ดังในรูป
และทอมสันได้นำผลการทดลองในลักษณะต่าง ๆ มาสรุปเกี่ยวกับแบบจำลองอะตอม
โดยทำเป็นขั้น ๆ ดังนี้
1.บรรจุก๊าซชนิดหนึ่งในหลอดรังสีแคโทดที่ภายในมีขั้วไฟฟ้าแอโนด
และแคโทดต่ออยู่กับเครื่องกำเนิดไฟฟ้ากระแสตรง ศักย์สูงที่ขั้วแอโนดเจาะรูเล็ก ๆ
ตรงกลาง และปลายด้านหนึ่งของหลอดรังสีมีฉากเรืองแสง ก. ทำด้วย ZnS วางไว้ นำหลอดรังสีนี้ต่อเข้ากับเครื่องสูบสูญญากาศ
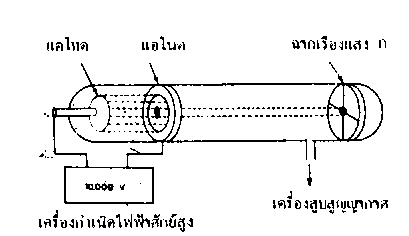
ในตอนแรกความดันในหลอดแก้วมีมาก จะยังไม่เห็นการเปลี่ยนแปลงใด ๆ
ที่ฉากเรืองแสง แม้ว่าจะใช้ศักย์ไฟฟ้าสูง ๆเมื่อลดความดันในหลอดแก้วให้ต่ำลงมาก ๆ
จนเกือบเป็นสุญญากาศ จะพบว่ามีจุดเรืองแสง หรือมีจุดสว่างบนฉากเรืองแสง ก.
เนื่องจาก ZnS มีสมบัติพิเศษคือ
ถ้าอนุภาคมีประจุมากระทบจะทำให้เกิดการเรืองแสงขึ้น ดังนั้นจากผลการทดลองทำให้
ทอมสันตั้งสมมติฐานว่า
จะต้องมีรังสีชนิดหนึ่งซึ่งมีประจุไฟฟ้าพุ่งเป็นเส้นตรงจากขั้วแคโทดมายังฉากเรืองแสง
ก. ซึ่งรังสีนี้อาจจะเกิดจากก๊าซที่มีอยู่ในหลอดแก้วนั้น
หรืออาจจะเกิดจากโลหะที่ทำขั้วไฟฟ้าก็ได้ ซึ่งทอมสันยังไม่ทราบ
รวมทั้งยังไม่ทราบว่ารังสีที่พุ่งออกมานั้นมีประจุเป็นอย่างไร
แต่ี้ทอมสันได้คาดว่าอะตอมคงจะไม่ใช่เป็นทรงกลมตันดังแบบจำลองของดอลตันแน่
แต่จะต้องมีอนุภาคเล็ก ๆ ที่มีประจุเป็นองค์ประกอบด้วย
การทดลองเพื่อทดสอบอนุภาคที่เกิดขึ้น
ในการทดสอบว่าประจุไฟฟ้าที่มากระทบฉากเรืองแสง ก. เป็นประจุบวกหรือลบ
ทอมสันจึงได้ทดลองต่อไปโดยใช้สนามไฟฟ้าเข้าช่วย โดยยึดหลักที่ว่า
อนุภาคที่มีประจุจะต้องเกิดการเบี่ยงเบนในสนามไฟฟ้าถ้าอนุภาคนั้นมีประจุบวกจะเบี่ยงเบนเข้าหาขั้วลบของสนามไฟฟ้าและถ้ามีประจุลบจะเบี่ยงเบนเข้าหาขั้วบวกทั้งนี้ศึกษาการเบี่ยงเบนได้จากฉากเรืองแสง
เมื่อเพิ่มขั้วไฟฟ้าเข้าไป 2 ขั้ว
โดยให้ขั้วไฟฟ้าทั้งสอง มีสนามไฟฟ้าตั้งฉากกับทิศทางของรังสีดังในรูป
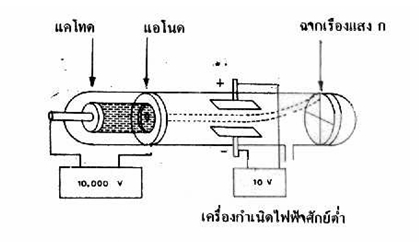
จากการทดลองพบว่า
- จุดสว่างบนฉากเรืองแสง ก. เบนไปจากตำแหน่งเดิม คือ
เบี่ยงเบนขึ้นสู่ด้านบนซึ่งถ้าลากเส้นจากขั้วไฟฟ้าจะเห็นว่ารังสีนั้นเบี่ยงเบนเข้าหาขั้วบวกของสนามไฟฟ้า
แสดงว่ารังสีจะต้องประกอบด้วยอนุภาคที่มีประจุลบเนื่องจากรังสีนี้เคลื่อนที่ออกมาจากขั้วแคโทดซึ่งเป็นขั้วลบ
จึงเรียกรังสีนี้ว่า รังสีแคโทดและเรียกหลอดแก้วที่ใช้ในการทดลองว่า
หลอดรังสีแคโทด
ข้อสรุปที่ทอมสันได้
- ทอมสันได้ตั้งสมมติฐานขึ้นว่าอะตอมประกอบด้วยอนุภาคเล็กๆ
ที่ส่วนหนึ่งมีประจุลบ
แต่มีประเด็นที่ต้องศึกษาเพิ่มอีก 2 ประเด็นคือ
ประเด็นที่ 1 อนุภาคที่มีประจุลบเหล่านี้ เกิดจากก๊าซในหลอดรังสี
หรือเกิดจากขั้วไฟฟ้า
ประเด็นที่ 2 รังสีแคโทดนี้จะเหมือนกันหรือไม่จะประกอบด้วยอนุภาคชนิดเดียวกันหรือไม่ถ้าใช้ก๊าซต่างชนิดกันจะมีลักษณะเหมือนหรือต่างกันอย่างไร
ผลการศึกษาเพิ่มเติมของทอมสัน
ทอมสันศึกษาสมบัติของรังสีแคโทดโดยหาอัตราส่วนระหว่างประจุต่อมวลของรังสีนั้นทั้งนี้อาศัยหลักที่ว่านอกจากรังสีแคโทดจะเบี่ยงเบนได้ในสนามไฟฟ้าแล้ว
ยังสามารถเบี่ยงเบนได้ในสนามแม่เหล็กด้วย
ในตอนแรกทอมสันได้ทดลอง
- เปลี่ยนก๊าซชนิดต่าง ๆ ในหลอดรังสีแคโทดแล้วทดลองในทำนองเดียวกัน
ปรากฏผลการทดลองได้ผลเหมือนเดิม
-เปลี่ยนชนิดของขั้วไฟฟ้าที่ใช้ทำแคโทดก็ยังคงพบว่าได้ผลการทดลองเหมือนเดิม
(คือจะมีรังสีที่ประกอบด้วยอนุภาคที่มีประจุลบพุ่งมาที่ฉากเรืองแสง ก. และรังสีเกิดการเบี่ยงเบนเข้าหาขั้วบวกของสนามไฟฟ้า จึงทำให้ไม่สามารถจะพิสูจน์ว่าอนุภาคที่มีประจุลบนั้นเป็นอนุภาคชนิดเดียวกันหรือไม่)
(คือจะมีรังสีที่ประกอบด้วยอนุภาคที่มีประจุลบพุ่งมาที่ฉากเรืองแสง ก. และรังสีเกิดการเบี่ยงเบนเข้าหาขั้วบวกของสนามไฟฟ้า จึงทำให้ไม่สามารถจะพิสูจน์ว่าอนุภาคที่มีประจุลบนั้นเป็นอนุภาคชนิดเดียวกันหรือไม่)
ดังนั้นทอมสันจึงได้ทำการทดลองต่อโดยนำหลอดรังสีวางไว้ในสนามแม่เหล็ก
ทั้งนี้ในทิศทางของสนามแม่เหล็กตั้งฉากกับสนามไฟฟ้าดังรูป
ในช่วงแรกที่ใส่สนามแม่เหล็กเข้าไป จุดสว่างบนฉากเรืองแสง ก. จะเบี่ยงเบนขึ้นด้านบน
เมื่อใส่สนามแม่เหล็กเข้าไป
และเพิ่มอำนาจสนามแม่เหล็กทีละน้อยจะพบว่าจุดสว่างบนฉากเรืองแสง ก. ค่อย ๆ
มีการเบี่ยงเบนน้อยลง คือ จุดเรืองแสงค่อย ๆ
กลับมาสู่ตำแหน่งเดิมของตอนที่ไม่มีสนามไฟฟ้า
แสดงว่าในขณะนี้ความแรงของสนามไฟฟ้ามีค่าเท่ากับความแรงของสนามแม่เหล็ก
จุดสว่างบนฉากเรืองแสงจึงไม่มีการเบี่ยงเบน
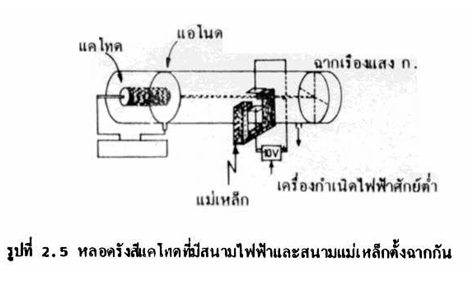
เมื่อนำความแรงเนื่องจากสนามไฟฟ้า
และความแรงเนื่องจากสนามแม่เหล็กที่กระทำต่ออนุภาคลบมาคำนวณอัตราส่วนของประจุต่อมวล
(e/m) ของอนุภาคลบนั้น
ปรากฏว่าได้ค่าคงที่เท่ากันทุกครั้ง ไม่ว่าทอมสันจะใช้ก๊าซชนิดใด
หรือไม่ว่าจะใช้โลหะใดเป็นแคโทดคือได้
e/m= 1.7 X 108 คูลอมบ์/กรัม
จากผลการทดลองและผลการคำนวณ ทำให้ทอมสันสรุปว่า
“อนุภาคลบในรังสีแคโทดจะต้องมีลักษณะเหมือนกัน
และอะตอมทุกชนิดย่อมจะมีอนุภาคที่มีประจุลบเป็นองค์ประกอบเหมือนกัน
และเรียกอนุภาคลบนี้ว่าอิเล็กตรอน”
เมื่อทดลองถึงตอนนี้ทำให้ทอมสันสรุปได้ว่า
อะตอมไม่ใช่สิ่งที่เล็กที่สุด
อะตอมของธาตุทุกชนิดจะต้องประกอบด้วยอิเล็กตรอนและอนุภาคอื่น ๆ ซึ่งในขณะนั้นยังไม่ทราบ
แบบจำลองอะตอมของทอมสัน(2)
หลอดรังสีแคโทด
เป็นเครื่องที่ใช่ทดลองเกี่ยวกับการนำไฟฟ้าโดยหลอดรังสีแคโทดจะมีความดันต่ำมาก
และความต่างศักย์สูงมาก วิลเลียม ครูกส์ได้สร้างหลอดรังสีแคโทดขึ้นมาโดยใช้แผ่นโลหะ
2 แผ่นเป็นขั้วไฟฟ้า
โดยต่อขั้วไฟฟ้าลบกับขั้วลบของเครื่องกำเนิดไฟฟ้าเรียกว่า แคโทด
และต่อขั้วไฟฟ้าบวกเข้ากับขั้วบวกของเครื่องกำเนิดไฟฟ้าเรียกว่า แอโนด
การค้นพบอิเล็กตรอนเซอร์โจเซฟ จอห์น ทอมสัน ดัดแปลงหลอดรังสีใหม่
ดังรูป
รังสีพุ่งจากด้าแคโทดไปยังด้านแอโนด
และจะมีรังสีส่วนหนึ่งทะุลุออกไปกระทบกับฉากเรืองแสงหลังจากนั้นทอมสันได้เพิ่มขั้วไฟฟ้าเข้าไปในหลอดรังสีแคโทดดังรูป
ปรากฎว่า รังสีนี้จะเบี่ยงเบนเข้าหาขั้วบวก แสดงว่า
รังสีนี้ต้องเป็นประจุลบแต่ไม่ทราบว่าเกิดจากก๊าซในหลอดรังสีแคโทดหรือเกิดจากขั้วไฟฟ้าทอมสันจึงทำการทดลองเกี่ยวกับการนำไฟฟ้าของก๊าซในหลอดรังสีแคโทดพบว่าไม่ว่าจะใช้ก๊าซใดบรรจุในหลอดหรือใช้โลหะใดเป็นแคโทดจะได้ผลการทดลองเหมือนเดิมจึงสรุปได้ว่า
อะตอมทุกชนิดมีอนุภาคที่มีประจุลบเป็นองค์ประกอบ เรียกว่า "อิเล็กตรอน"
การค้นพบโปรตอนเนื่องจากอะตอมเป็นกลางทางไฟฟ้า
และการที่พบว่าอะตอมของธาตุทุกชนิดประกอบด้วยอิเล็กตรอนซึ่งมีประจุไฟฟ้าเป็นลบ
ทำให้นักวิทยาศาสตร์เชื่อว่าองค์ประกอบอีกส่วนหนึ่งของอะตอม จะต้องมีประจุบวกด้วย
ออยแกน โกลด์สไตน์ (Eugen Goldstein) นักวิทยาศาสตร์ชาวเยอรมัน
ได้ทดลองเกี่ยวกับหลอดรังสีแคโทด โดยดัดแปลงหลอดรังสีแคโทด ดังรูป
ผลการทดลองของโกสไตน์
ผลการทดลองของโกสไตน์
เมื่อผ่านกระแสไฟฟ้า ปรากฏว่ามีจุดสว่างเกิดขึ้นทั้งฉากเรืองแสง ก.
และฉากเรืองแสง ข.
โกลสไตน์ได้อธิบายว่าจุดเรืองแสงที่เกิดขึ้นบนฉากเรืองแสงก.จะต้องเกิดจากที่ประกอบด้วยอนุภาคที่มีประจุไฟฟ้าบวกเคลื่อนที่ผ่านรูตรงกลางของแคโทด
ไปยังฉากเรืองแสงแต่ยังไม่ทราบว่ารังสีที่มีประจุไฟฟ้าบวกนี้เกิดจากอะตอมของก๊าซหรือเกิดจากอะตอมของขั้วไฟฟ้า
และมีลักษณะเหมือนกันหรือไม่
โกลสไตน์ได้ทดลองเปลี่ยนชนิดของก๊าซในหลอดแก้วปรากฏว่าอนุภาคที่มีประจุไฟฟ้าบวกเหล่านี้มีอัตราส่วนประจุต่อมวลไม่เท่ากัน
ขึ้นอยู่กับชนิดของก๊าซที่ใช้และเมื่อทดลองเปลี่ยนโลหะที่ใช้ทำเป็นขั้วไฟฟ้าหลายๆชนิดแต่ให้ก๊าซในหลอดแก้วชนิดเดียวกัน
ปรากฏว่า
ผลการทดลองได้อัตราส่วนประจุต่อมวลเท่ากันแสดงว่าอนุภาคบวกในหลอดรังสีแคโทดเกิดจากก๊าซ
ไม่ได้เกิดจากขั้วไฟฟ้า
ไม่ได้เกิดจากขั้วไฟฟ้า
สรุปแบบจำลองของทอมสัน
จากผลการทดลอง ทั้งของทอมสันและโกลด์สไตน์ ทำให้ทอมสันได้ข้อมูลเกี่ยวกับอะตอมมากขึ้น จึงได้เสนอแบบจำลองอะตอม ดังนี้อะตอมมีลักษณะเป็นทรงกลมประกอบด้วยอนุภาคโปรตอนที่มีประจุไฟฟ้าเป็นบวกและอนุภาคอิเล็กตรอนที่มีประจุไฟฟ้าเป็นลบ กระจัดกระจายอย่างสม่ำเสมอในอะตอมอะตอมที่มีสภาพเป็นกลางทางไฟฟ้าจะมีจำนวนประจุบวกเท่ากับจำนวนประจุลบ
จากผลการทดลอง ทั้งของทอมสันและโกลด์สไตน์ ทำให้ทอมสันได้ข้อมูลเกี่ยวกับอะตอมมากขึ้น จึงได้เสนอแบบจำลองอะตอม ดังนี้อะตอมมีลักษณะเป็นทรงกลมประกอบด้วยอนุภาคโปรตอนที่มีประจุไฟฟ้าเป็นบวกและอนุภาคอิเล็กตรอนที่มีประจุไฟฟ้าเป็นลบ กระจัดกระจายอย่างสม่ำเสมอในอะตอมอะตอมที่มีสภาพเป็นกลางทางไฟฟ้าจะมีจำนวนประจุบวกเท่ากับจำนวนประจุลบ
แบบจำลองอะตอมของรัทเทอร์ฟอรด์
หลังจากนักวิทยาศาสตร์ชาวฝรั่งเศส Henri Becquerel ได้พบสารกัมมันตรังสี และเรินต์เกน (W.K. Rontgen) ค้นพบ
X-ray
Lord Ernest Ruthetford นักวิทยาศาสตร์ชาวนิวซีแลนด์ได้ทำการการศึกษาธรรมชาติของรังสีที่เกิดจากสารกัมมันตรังสี
พบว่ามี 3 ชนิด คือ
1. รังสี เอลฟา ( α-ray) ประกอบด้วยอนุภาคที่มีประจุไฟฟ้าเป็นบวก (+2)
เป็นนิวเคลียสของอะตอมของธาตุฮีเลียม คือประกอบด้วย Proton 2
ตัว และ Neutron 2 ตัว ( )
อำนาจผ่านทะลุวัตถุได้น้อยมาก ถูกกั้นโดยกระดาษเพียงแผ่นเดียวหรือสองแผ่น He42
2. รังสีเบตา (β-ray) ประกอบด้วยอิเล็กตรอนที่มีพลังงานสูง
มีอำนาจการผ่านทะลุสูงกว่ารังสีเเอลฟา ถูกกั้นโดยใช้แผ่นโลหะบางๆ
3. รังสีแกมมา (γ-ray) แสดงสมบัติเป็นคลื่นแม่เหล็กไฟฟ้าที่มีความยาวคลื่นสั้นมากคล้าย
X-ray รังสีแกมมาไม่มีมวลไม่มีประจุ มีอำนาจผ่านทะลุสูง
ถูกกั้นได้โดยแผ่นตะกั่วหนา
หลังจากที่ได้ศึกษาเกี่ยวกับสารกัมมันตรังสีมากขึ้น
ได้มีการค้นพบรังสีต่าง ๆ ซึ่งเกิดจากการสลายตัวของสารกัมมันตรังสี เช่น
รังสีแอลฟา (a ) เบตา (b) และแกรมมา (g)
โดยเฉพาะรังสีแอลฟาซึ่งจัดว่าเป็นอนุภาคที่มีประจุไฟฟ้าบวก และมีมวลมากกว่ารังสีเบตา
และแกรมมา เมื่ออนุภาคแอลฟาเคลื่อนที่ไปกระทบกับอนุภาคอื่น ๆ ที่มีมวลน้อยกว่า
จึงไม่ค่อยมีการเบี่ยงเบนซึ่งทำให้นักวิทยาศาสตร์บางท่านนำเอารังสีแอลฟาไปศึกษาเกี่ยวกับโครงสร้างของอะตอม
เช่น เออร์เนสต์ รัทเทอร์ฟอร์ด (Ernest Rutherford) นักวิทยาศาสตร์ชาวนิวซีแลนด์
เป็นต้น
ในปี พ.ศ. 2454 รัทเทอร์ฟอร์ด
ได้ทำการทดลองในประเภทอังกฤษร่วมกับ ฮันส์ ไกเกอร์ และเออร์เนส์ มาร์สเดน
ศึกษาทิศทางการเคลื่อนที่ของอนุภาคแอลฟา
เมื่อยิงอนุภาคแอลฟาซึ่งได้จากการสลายตัวของสารกัมมันตรังสี เข้าไปที่แผ่นทองคำบาง
ๆ
การตรวจสอบทิศทางการเคลื่อนที่ของอนุภาคแอลฟาหลังจากกระทบแผ่นทองคำแล้ว
ทำได้โดยใช้ฉากเรืองแสงขดเป็นวงกลมล้อมรอบแผ่นทองคำไว้
โดยเว้นที่เฉพาะบริเวณที่จะให้อนุภาคแอลฟาผ่านเข้ามาเท่านั้น ทุก ๆ
ครั้งที่อนุภาคแอลฟากระทบฉากเรืองแสงจะพบว่ามีจุดสว่างเกิดขึ้นที่ฉากเรืองแสงนั้น
(อนุภาคแอลฟาคือ นิวเคลียสของธาตุฮีเลียม ซึ่งประจุบวก
ดังนั้นเมื่อกระทบฉากเรืองแสงจึงมีจุดสว่างเกิดขึ้น
ทำให้ทราบทิศทางการเคลื่อนที่ของอนุภาคแอลฟา)
จากการทดลองพบว่าอนุภาคแอลฟาส่วนใหญ่จะวิ่งเป็นแนวเส้นตรง
ผ่านแผ่นทองคำไปกระทบฉากเรืองแสง ซึ่งก็คือบริเวณจุด ก. ที่อยู่หลังแผ่นทองคำในรูป
บางส่วนจะเบี่ยงเบนไปจากแนวเส้นตรง คือบริเวณจุด ข. ของฉากเรืองแสง
และมีน้อยครั้งมากที่อนุภาคสะท้อนกลับมากระทบฉากเรืองแสงที่จุด ค.
ซึ่งอยู่หน้าแผ่นทองคำ
จากผลการทดลอง ทำให้รัทเทอร์ฟอร์ดแปลกใจมาก
เพราะถ้านำแบบจำลองอะตอมของทอมสันมาอธิบายทิศทางที่น่าจะเกิดขึ้น
เมื่อยิงอนุภาคแอลฟาไปที่แผ่นทองคำ อนุภาคส่วนใหญ่ควรจะเบี่ยงเบนไปจากแนวเส้นตรง
ทั้งนี้ เพราะตามแบบจำลองอะตอมของทอมสัน อะตอมประกอบด้วยอนุภาคบวกและลบ
กระจายอยู่ทั่วไปในอะตอม เมื่อยิงอนุภาคแอลฟาซึ่งมีประจุบวกเข้าไปในอะตอมของแผ่นทองคำ
อนุภาคแอลฟาควรจะผลักกับโปรตอนซึ่งมีประจุบวกเหมือนกัน
อันจะเป็นผลทำให้ทิศทางของอนุภาคแอลฟาเบี่ยงเบนไปดังในรูปที่ 1-12
แต่จากผลการทดลอง
การที่อนุภาคแอลฟาส่วนใหญ่วิ่งผ่านแผ่นทองคำเป็นแนวเส้นตรง
จึงทำให้รัทเทอร์ฟอร์ดแปลกใจมาก โดยเฉพาะอนุภาคแอลฟาส่วนที่สะท้อนกลับยิ่งทำให้แปลกใจมากยิ่งขึ้น
ทั้งนี้เพราะการที่อนุภาคแอลฟาสะท้อนกลับได้แสดงว่าภายในอะตอมจะต้องมีสิ่งที่มีมวลมากขวางทางอยู่
เมื่ออนุภาคแอลฟาไปชนจึงเกิดการสะท้อนกลับ
แต่จากแบบจำลองอะตอมของทอมสันภายในอะตอมไม่มีสิ่งหนึ่งสิ่งใดอยู่รวมกันเป็นกลุ่มเป็นก้อนเลย
ดังนั้นการสะท้อนกลับของอนุภาคแอลฟาเป็นมุมมากกว่า 90 องศา
จึงไม่มีทางเกิดขึ้นได้
แต่จากผลการทดลองของ Rutherford ปรากฎว่าอนุภาคแอลฟาส่วนใหญ่วิ่งผ่านแผ่นทองคำเป็นเส้นตรง
และมีส่วนที่เบี่ยงเบนออก และบางส่วนสะท้อนกลับ แสดงว่าแบบจำลองของ Thomson
ไม่สอดคล้องกับผลการทดลอง Rutherford อธิบายผลการทดลองดังนี้
1. การที่อนุภาคแอลฟาส่วนใหญ่วิ่งผ่านแผ่นทองคำเป็นเส้นตรงแสดงว่าอะตอมไม่ใช่ของแข็งทึบตันแต่ภายในอะตอมมีที่ว่างอยู่มาก
(ผลการทดลอง จุด ก เป็นจุดที่รังสีแอลฟาผ่านช่องว่างในอะตอมไปยังฉากมาก
จุดนี้เรืองแสงมาก แสดงว่าอะตอมมีช่องว่างมาก)
2. อนุภาคแอลฟาบางอนุภาคที่หักเหออกจากทางเดิมเพราะภายในอะตอมมีอนุภาคที่มีมวลมากและมีประจุเป็นบวกสูง
มีขนาดเล็ก ดังนั้นเมื่ออนุภาคแอลฟาเข้าใกล้อนุภาคนี้จะถูกผลักให้เบนออกจากทางเดิม
หรือเมื่อนุภาคแอลฟากระทบโดยตรงก็เกิดการสะท้อนกลับ (เกิดการเรืองแสงที่จุด ข และ
ค
การที่อนุภาคแอลฟาส่วนใหญ่เคลื่อนที่ผ่านอะตอมของทองคำเป็นแนวเส้นตรง
แสดงว่าภายในอะตอมทองคำควรจะมีที่ว่างเป็นจำนวนมาก
และการที่อนุภาคแอลฟาบางส่วนสะท้อนกลับแสดงว่าภายในอะตอมควรจะมีอนุภาคอะไรสักอย่างที่รวมกันเป็นกลุ่มก้อน
และมีปริมาณมากพอ รวมทั้งมีมวลมากพอที่จะทำให้อนุภาคสะท้อนกลับเมื่อกระทบถูกได้
เนื่องจากภายในอะตอม (ในขณะนั้น) มีแต่อิเล็กตรอนและโปรตอน
โดยที่อิเล็กตรอนมีมวลน้อยมาก
รัทเทอร์ฟอร์ดจึงคิดว่าอนุภาคส่วนที่มารวมกันเป็นกลุ่มก้อนจึงน่าจะเป็นอนุภาคของโปรตอน
ดังนั้นเพื่อที่จะอธิบายผลการทดลอง รัทเทอร์ฟอร์ดจึงเสนอแบบจำลองแบบใหม่
เรียกว่าแบบจำลองอะตอมของรัทเทอร์ฟอร์ดดังนี้
“อะตอมมีลักษณะเป็นทรงกลม
ประกอบด้วยนิวเคลียสซึ่งก็คือโปรตอนที่รวมกันอยู่ตรงกลางของอะตอม
และมีอิเล็กตรอนวิ่งวนอยู่รอบ ๆ นิวเคลียส นิวเคลียสมีขนาดเล็ก แต่มีมวลมากและมีประจุบวก
ส่วนอิเล็กตรอนจะมีมวลน้อยและมีประจุลบ จำนวนอิเล็กตรอนจะเท่ากับจำนวนโปรตอน”
คลื่น
สมบัติของคลื่นและสเปกตรัมของแสง (1)
แบบจำลองอะตอมของรัทเทอร์ฟอร์ด
ใช้อธิบายเกี่ยวกับการทดลองยิงอนุภาคแอลฟาไปที่แผ่นทองคำ
แต่อธิบายปัญหาบางอย่างไม่ได้ เช่น
ทำไมโปรตอนซึ่งมีประจุบวกจึงรวมกันเป็นนิวเคลียสได้
และทำไมอิเล็กตรอนซึ่งมีประจุลบจึงเคลื่อนที่รอบ ๆ นิวเคลียสได้
หลังจากการค้นพบนิวตรอน
สามารถอธิบายเหตุผลที่โปรตอนสามารถรวมกันเป็นนิวเคลียสได้ 2 ลักษณะดังนี้
1.โปรตอนและนิวตรอนที่จะเปลี่ยนกลับไปกลับมาได้
ถ้า n คือ นิวตรอน และ p คือ โปรตอน
จะเขียนสมการแสดงการเปลี่ยนแปลงกลับไปกลับมาระหว่างโปรตอน และนิวตรอนได้ดังนี้
Neutron + Positive charge ® Proton
หรือ n + e ® p
และ Proton + Negative charge ® Neutron
หรือ p + e ® n
จะเห็นได้ว่า
โปรตอนสามารถเปลี่ยนไปเป็นนิวตรอนได้โดยอาศัยอิเล็กตรอน
และนิวตรอนสามารถเปลี่ยนเป็นโปรตอนได้โดยโปสิตรอน (e ) ซึ่งเป็นอนุภาคที่ไม่เสถียรภายในนิวเคลียส
เขียนเป็นสมการรวมได้ดังนี้
การที่โปรตอนและนิวตรอนสามารถจะเปลี่ยนกลับไปกลับมาได้จึงก่อให้เกิดแรงยึดเหนี่ยวระหว่างอนุภาคทั้งสอง
ซึ่งทำให้อนุภาคทั้งสองอยู่ด้วยกันได้ และทำให้นิงเคลียสมีความเสถียร
2.พิจารณาในแง่ของประจุเนื่องจากนิวตรอนไม่มีประจุไฟฟ้าจึงเป็นกลางทางไฟฟ้า
นิวตรอนจึงไม่มีแรงดูดหรือแรงผลักระหว่างอนุภาค ดังนั้นจึงทำหน้าที่เชื่อม (Cement)
ระหว่างโปรตอนกับโปรตอน
โดยการแทรกอยู่ระหว่างโปรตอนกับโปรตอนซึ่งทำให้โปรตอนอยู่ในระหว่าง ลดแรงผลักลงได้
จึงทำให้โปรตอนอยู่รวมกันได้
จะเห็นได้ว่าแบบจำลองอะตอมใหม่ที่มีนิวตรอนสามารถอธิบายการรวมตัวกันของโปรตอนในนิวเคลียสได้
แต่ยังไม่สามารถอธิบายได้ว่าอิเล็กตรอนอยู่รวมกันรอบ ๆ นิวเคลียสได้อย่างไร
อิเล็กตรอนทั้งหมดอยู่รวมกันหรือมีการแบ่งกลุ่ม ๆ
หรือมีตัวกลางแบบเดียวกับนิวตรอนในนิวเคลียส
นอกจากนี้ยังไม่สามารถอธิบายได้ว่าเหตุใดเมื่อเผาสารประกอบชนิดต่าง ๆ
สีของเปลวไฟจึงไม่เหมือนกัน
นักวิทยาศาสตร์ได้พยายามศึกษาลักษณะของการจัดเรียงอิเล็กตรอนรอบ
ๆ อะตอม โดยแบ่งการศึกษาออกเป็น 2
ส่วนส่วนแรกเป็นการศึกษาเกี่ยวกับสเปกตรัมของอะตอมซึ่งจะทำให้ทราบว่าภายในอะตอมมีการจัดระดับพลังงานเป็นชั้น
ๆ
ในแต่ละชั้นจะมีอิเล็กตรอนบรรจุอยู่ส่วนที่สองเป็นการศึกษาเกี่ยวกับพลังงานไอออนไนเซชัน
เพื่อจะดูว่าในแต่ละระดับพลังงานจะมีอิเล็กตรอนบรรจุอยู่ได้กี่ตัว
สเปกตรัมหมายถึงอนุกรมของแถบสีหรือ
หรือเส้นที่ได้จากการผ่านพลังงานรังสีเข้าไปในสเปกโตรสโคป
ทำให้พลังงานรังสีแยกออกเป็นแถบหรือเป็นเส้นที่มีความยาวคลื่นต่าง ๆ
เรียงลำดับกันไป
สเปกโตรสโคป (Spectroscope) หรือสเปกโตรมิเตอร์ (Spectrometer)หมายถึง เครื่องมือที่ใช้แยกสีตามความถี่
หรือเครื่องมือที่ใช้ศึกษาเกี่ยวกับสเปกตรัม
สเปกตรัม แบ่งเป็น 2 ประเภท คือ
ก. สเปกตรัมแบบต่อเนื่อง (Continuous spectrum) เป็นสเปกตรัมที่ประกอบด้วยแถบสีที่มีความถี่ต่อเนื่องกันไปอย่างกลมกลืนกัน
เช่น สเปกตรัมของแสงอาทิตย์
ข. สเปกตรัมไม่ต่อเนื่อง (Discontinuous spectrum) หรือเรียกเส้นสเปกตรัม
ลักษณะของสเปกตรัมจะเป็นเส้นหรือแถบสีเล็ก ๆ ที่ไม่เกิดต่อเนื่องกันไป
แต่มีการเว้นช่วงของความถี่ที่เส้นสเปกตรัมเกิด เช่น สเปกตรัมธาตุไฮโดรเจน
ธาตุฮีเลียม เป็นต้น
สเปกตรัมที่ไม่ต่อเนื่องจะมีบทบาทที่สำคัญในการศึกษาโครงสร้างอะตอม
เนื่องจากอะตอมของธาตุต่าง ๆ
จะมีเส้นสเปกตรัมเฉพาะตัวคล้ายกับลายนิ้วมือของคนแต่ละคนที่ไม่เหมือนกันสำหรับสเปกตรัมของธาตุ
ถ้าพลังงานรังสีเกิดจากการเปลี่ยนแปลงของอะตอมจะเรียกว่า “อะตอมมิกสเปกตรัม (Atomic
spectrm) ”
ความยาวคลื่น (Wavelength) ใช้สัญลักษณ์เป็น l (อ่านว่า แลมบ์ดา) เป็นสมบัติที่สำคัญของคลื่นหมายถึง
ระยะทางที่คลื่นเคลื่อนที่ครบ 1 รอบพอดี (คือระยะทางจากจุด
ก. ถึงจุด ข. ในรูป หรือระยะทางจากจุดประปลายหนึ่งไปยังอีกปลายหนึ่ง) ความยาวคลื่นมีหน่วยเป็นเมตร
( m ) หรือหน่วยย่อยของเมตร เช่น
นาโนเมตร (nm) โดย 1 nm = 10-9เมตร
ความถี่ของคลื่น ใช้สัญลักษณ์เป็น n (อ่านว่า นิว) หมายถึง
จำนวนรอบของคลื่นที่เคลื่อนที่ผ่านจุดใดจุดหนึ่งในเวลา 1 วินาที
ความถี่ของคลื่นจึงมีหน่วยเป็นจำนวนรอบต่อวินาที ( S-1หรือ cycle/s)
หน่วยนี้มีชื่อเรียกอีกอย่างหนึ่งว่าเฮิร์ตซ์ ( Hertz) หรือใช้สัญลักษณ์เป็น Hz
แอมปลิจูด ( Amplitude) คือ ความสูงของยอดคลื่น
คลื่นที่จะศึกษากันในที่นี้เป็นคลื่นแม่เหล็กไฟฟ้าในช่วงความยาวคลื่นระหว่าง
380-750 nm ซึ่งเป็นช่วงคลื่นที่มีความยาวและความถี่ที่ประสาทตาของคนจะรับได้เรียกคลื่นแม่เหล็กไฟฟ้าช่วงดังกล่าวนี้ว่า
“แสงขาว (Visibel light)” สำหรับช่วงอื่น
ๆ นอกจากนี้จะไม่นำมาศึกษาเนื่องจากประสาทตาไม่สามารถจะรับได้ เช่น
ช่วงอัลตราไวโอเลต (Utraviolet หรือตัวอย่คือ U.V. ) อินฟาเรด (Infrared หรือตัวย่อ I.R.) และไมโครเวฟ (Microwave) เป็นต้น
ตารางที่3 สมบัติของคลื่นในช่วงความยาวต่าง ๆ กัน บางช่วง
ช่วงคลื่น
|
ความยาวคลื่น(m)
|
ความถี่คลื่น(Hz)
|
อัลตราไวโอเลต
แสงขาว
อินฟราเรด
ไมโครเวฟ
|
1 x 10-7- 3 x 10-7
3 x 10-7- 7 x 10-7
2.5 x 10-6- 3 x 10-5
1 x 10-3- 3 x 10-1
|
1.5 x 1015
0.6 x 1015
3.0 x 1013
3.0 x 1010
|
การศึกษาเกี่ยวกับสเปกตรัมนี้มีมาตั้งแต่สมัยนิวตัน
โดยใช้ปริซึมแยกแสงอาทิตย์ออกเป็นแถบสีรวม 7 สี ซึ่งภายหลังเคอร์ชอฟ (Gustav Krchhoff) ชาวเยอรมัน ได้ประดิษฐ์สเปกโตรสโคปขึ้น ใช้ในการแยกสเปกตรัมของแสงขาว
และต่อมาบุนเซน (Robert Bunsen) ได้นำความรู้เกี่ยวกับสเปกตรัมไปวิเคราะห์แร่ชนิดต่าง
ๆ ซึ่งทำให้ทราบว่าแร่นั้นมีธาตุอะไรเป็นองค์ประกอบ
คลื่น
สมบัติของคลื่นและสเปกตรัมของแสง (2)
การศึกษาเกี่ยวกับสเปกตรัมนี้มีมาตั้งแต่สมัยนิวตัน
โดยใช้ปริซึมแยกแสงอาทิตย์ออกเป็นแถบสีรวม 7 สี ซึ่งภายหลังเคอร์ชอฟ (Gustav Krchhoff) ชาวเยอรมัน ได้ประดิษฐ์สเปกโตรสโคปขึ้น ใช้ในการแยกสเปกตรัมของแสงขาว
และต่อมาบุนเซน (Robert Bunsen) ได้นำความรู้เกี่ยวกับสเปกตรัมไปวิเคราะห์แร่ชนิดต่าง
ๆ ซึ่งทำให้ทราบว่าแร่นั้นมีธาตุอะไรเป็นองค์ประกอบ
เมื่อให้แสงขาวส่องผ่านปริซึม
แสงขาวจะแยกออกเป็นแถบสีต่าง ๆ ต่อเนื่องกัน 7 สี เหมือนสีรุ้ง คือ สีม่วง คราม น้ำเงิน เขียว
เหลือง ส้ม และแดง นักวิทยาศาสตร์เรียกแถบสีต่อเนื่องกันทั้ง 7 สีนี้ว่า “ สเปกตรัมของแสงสีขาว ” การที่แสงขาวสามารถแยกออกเป็นสเปกตรัมสีต่าง ๆ
กันก็เนื่องจากแสงขาวประกอบด้วยสีต่าง ๆ ทั้ง 7 สี
ซึ่งมีความยาวคลื่นต่าง ๆ จะทำให้เกิดการหักเหตามขนาดของมุมต่าง ๆ
แสงที่มีความยาวคลื่นไม่เท่ากันจะเกิดการหักเหในปริซึมได้ไม่เท่ากัน
ซึ่งทำให้เกิดการแยกออกเป็นแถบแสงสีต่าง ๆ และต่อเนื่องกันเป็นแถบสเปกตรัม
ตารางที่4 แถบสีของสเปกตรัมของแสงขาว
สีของสเปกตรัม
|
ความยาวคลื่น(nm)
|
ม่วง
คราม
น้ำเงิน
เขียว
เหลือง
ส้ม
แดง
|
380 - 420
420 - 460
460 - 490
490 - 580
580 - 590
590 - 650
650 - 700
|
สำหรับคลื่นแม่เหล็กไฟฟ้าในช่วงอื่น ๆ
ก็มีการหักเหเมื่อผ่านปริซึมหรือผ่านตัวกลางเช่นเดียวกัน
แต่ไม่สามารถมองเห็นได้เหมือนแสงขาว
การศึกษาสเปกตรัมของคลื่นแม่เหล็กไฟฟ้าได้รับความสนใจเป็นอย่างมากนักวิทยาศาสตร์
ซึ่งต่อมามักซ์ พลังค์(Max Planck)นักวิทยาศาสตร์ ชาวเยอรมัน
ได้พบว่าคลื่นแม่เหล็กไฟฟ้าหรือแสงเป็นพลังงานรูปหนึ่งและพลังงานของคลื่นแม่เหล็กไฟฟ้ามีส่วนสัมพันธ์กับความถี่และความยาวของคลื่นโดยสรุปเป็นกฎว่า
“พลังงานของคลื่นแม่เหล็กไฟฟ้าจะเป็นสัดส่วนโดยตรงกับความถี่ของคลื่นนั้น”
เขียนเป็นความสัมพันธ์ได้ดังนี้
E a
E = h
เมื่อ E = พลังงานของคลื่นแม่เหล็กไฟฟ้า (หน่วยเป็น จูล )
h = ค่าคงที่ของพลังค์ ( Plank,constant)
= 6.625 x 10-34Js
= ความถี่ของคลื่นแม่เหล็กไฟฟ้า (Hz
หรือ s-1)
เรียกสมการดังกล่าวนี้ว่ากฎของพลังค์
ในการศึกษาเกี่ยวกับคลื่นโดยทั่ว ๆ ไปมักจะวัด
เป็นความยาวคลื่น ซึ่งความยาวคลื่นมีส่วนสัมพันธ์กับความถี่ของคลื่นดังนี้
เมื่อ c คือ ความเร็วของคลื่นแม่เหล็กไฟฟ้าในสูญญากาศ
หรือความเร็วแสงในสูญญากาศ
c = 2.99 x 108ms-1หรือ โดยประมาณ c
= 3.0 x 108ms-1
จากความสัมพันธ์ของความยาวคลื่นของความยาวคลื่นแม่เหล็กไฟฟ้า
ทำให้สามารถเขียนกฎของพลังค์
เพื่อแสดงความสัมพันธ์ระหว่างพลังงานของคลื่นแม่เหล็กไฟฟ้ากับความยาว
และความถี่ของคลื่น ได้ดังนี้
E = h = h
เนื่องจากแสงขาวประกอบด้วยแสงสีต่าง ๆ รวม 7 สี
แต่ละสีมีลักษณะเป็นแถบสเปกตรัมจึงมีความยาวคลื่นเป็นช่วง
ดังนั้นค่าของความถี่และพลังงานจึงเป็นช่วงด้วย
การคำนวณเกี่ยวกับพลังงานของคลื่นจึงต้องระบุความยาวคลื่นหรือความถี่ที่แน่นอนด้วย
เช่น แสงสีเขียวมีความยาวคลื่นระหว่าง 490 - 580 จะมีพลังงานอยู่ระหว่าง
4.06 x 10-19และ 3.43 x 10-19จูล
ถ้าแสงสีเขียวที่มีความยาวคลื่น 520 nm จะมีพลังงาน 3.82
x 10-19จูล เป็นต้น
ตารางที่5 พลังงาน ความยาว และความถี่ของแสงสีขาว
สีของสเปกตรัม
|
ความยาวคลื่น (nm)
|
ความถี่คลื่น (Hz)
|
พลังงาน (J)
|
ม่วง
คราม
น้ำเงิน
เขียว
เหลือง
ส้ม
แดง
|
380 - 420
420 - 460
460 - 490
490 - 580
580 - 590
590 - 650
650 - 700
|
7.89 x 1014- 7.14 x 1014
7.14 x 1014- 6.52 x 1014
6.52 x 1014- 6.12 x 1014
6.12 x 1014- 5.17 x 1014
5.17 x 1014- 5.08 x 1014
5.08 x 1014- 4.62 x 1014
4.62 x 1014- 4.29 x 1014
|
5.23 x 10-19- 4.73 x 10-19
4.73 x 10-19- 4.32 x 10-19
4.32 x 10-19- 4.06 x 10-19
4.06 x 10-19- 3.43 x 10-19
3.43 x 10-19- 3.37 x 10-19
3.37 x 10-19- 3.06 x 10-19
3.06 x 10-19- 2.84 x 10-19
|
จากตารางจะเห็นได้ว่าในแสงขาวซึ่งมีสีต่าง ๆ รวม 7 สี
แสงสีม่วงจะมีความยาวคลื่นสั้นที่สุด แต่มีความถี่สูงสุด และมีพลังงานสูงสุด
ในขณะที่แสงสีแดงมีความยาวคลื่นมากที่สุด แต่มีความถี่ต่ำสุดและมีพลังงานต่ำที่สุด
หรือพิจารณาจากสูตร E = h= h
ถ้า มาก และ E จะน้อย
แต่ถ้า น้อย และ E จะมาก
ตัวอย่างเพิ่มเติมที่ 1เส้นสเปกตรัมของไฮโดรเจน 2 เส้น คือเส้นสีม่วงมีความยาวคลื่น 410 nm และเส้นสีน้ำเงินมีความยาวคลื่น
434 nm จะมีพลังงานต่างกันเท่าใด ?
วิธีทำจากสูตร E = h = h
c = 3.0 x 108m/s
h = 6.625 x 10-34Js
สำหรับเส้นสีม่วง ; = 410 nm = 4.10 x 10-7m
E = 6.625 x 10-34Js x = 4.85 x 10-19J
สำหรับเส้นสีม่วง ; = 434 nm = 4.34 x 10-7m
E = 6.625 x 10-34Js x
= 4.58 x 10-19J
มีพลังงานต่างกันเท่ากับ 4.85 x 10-19J - 4.58 x 10-19J = 2.7 x 10-20J
ตัวอย่างเพิ่มเติมที่ 2ธาตุชนิดหนึ่งเมื่อนำไปเผาไฟ
จะเกิดเส้นสเปกตรัมหลายเส้น จากการทดลองพบว่าเส้นสเปกตรัมเส้นหนึ่งมีพลังงาน 4.0
x 10-19J สเปกตรัมเส้นดังกล่าวจะมีความยาวและความถี่คลื่นเป็นเท่าใด
และมีสีอะไร
วิธีทำE = h
E = 4.0 x 10-19J
h = 6.625 x 10-34Js
c = 2.998 x 108m/s
จะได้ 4.0 x 10-19J = 6.625 x 10-34Js x
= 497 x 10-9m = 497 nm
จาก = 6.04 x 1014Hz
สเปกตรัมเส้นนี้มีความยาวคลื่น 497 นาโนเมตร ความถี่ 6.04 x
1014Hz และตรงกับสีเขียว (ช่วงสีเขียวอยู่ระหว่างความยาวคลื่น 490
- 580 นาโนเมตร)

ไม่มีความคิดเห็น:
แสดงความคิดเห็น